Leczenie Plazmowe. Technologia nagroda Nobla ! Ponad 100 schorzeń !
Sprzedający:
Dołączone pliki
Zobacz VIDEO >>>
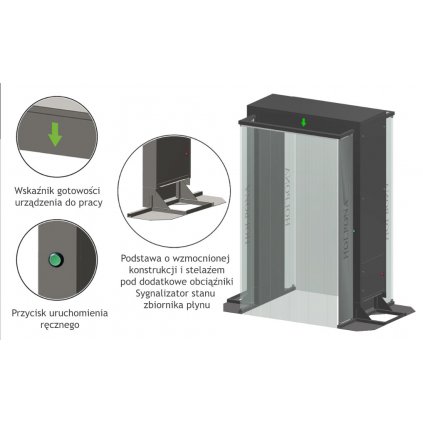
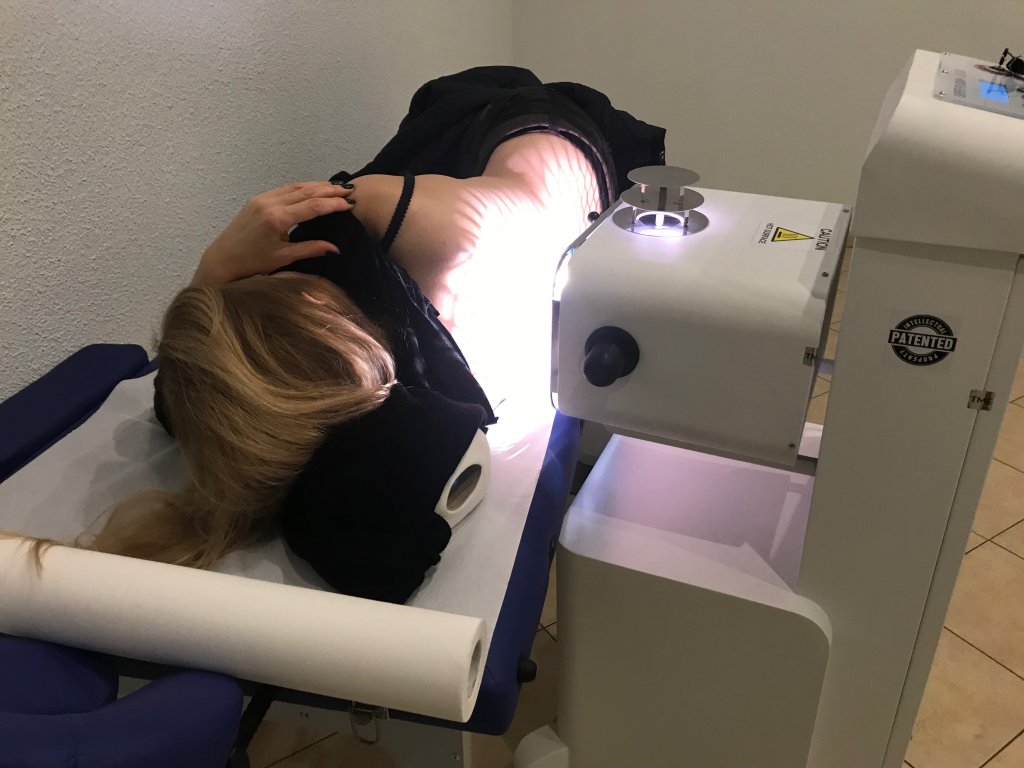
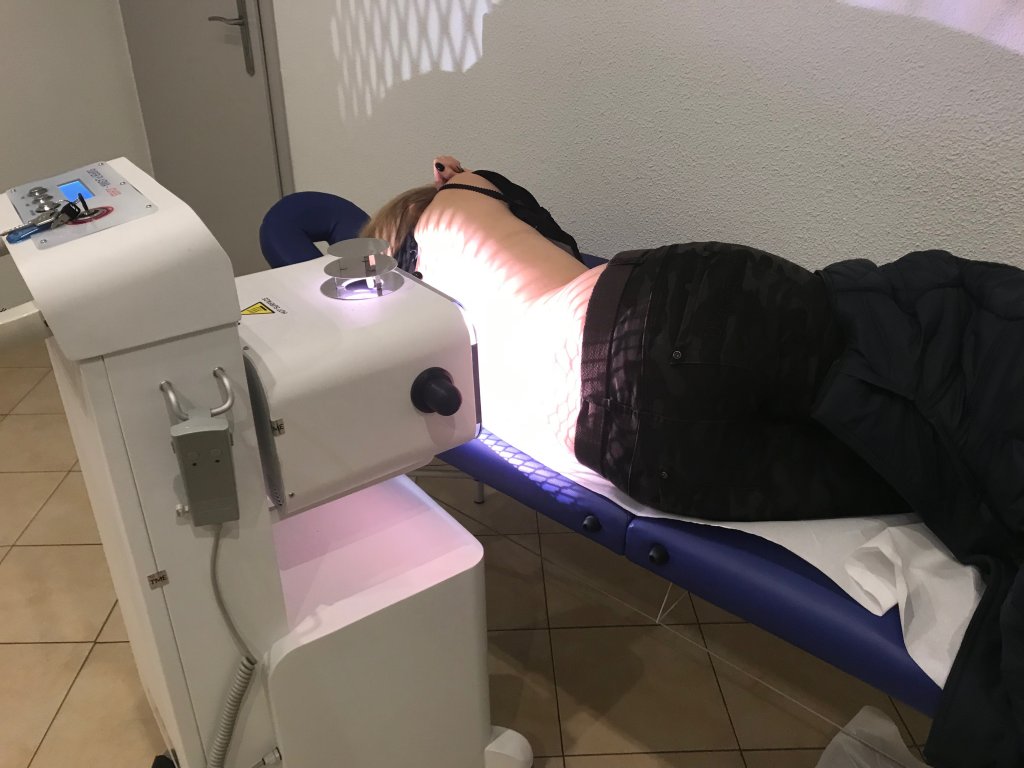
Pierwsze takie urządzenie na rynku:
Fotoplazmatyczna terapia komórkowo - tkankowa.
Posiadamy procedury naświetlania dla wielu schorzeń.
Nagroda Nobla za technologię.
Ponad 50 % społeczeństwa w każdym kraju ma wskazania do korzystania z tej technologii.
Oferujemy dla: klinik, szpitali, ośrodków rehabilitacyjnych, gabinetów specjalistycznych,sanatoriów, domów opieki, klubów sportowych, ośrodków z infrastrukturą zabiegową oraz osób prywatnych, pierwsze na rynku mobilne urządzenie do fotoplazmatycznej terapii komórkowo - tkankowej, które ma zastosowanie w leczeniu wielu schorzeń.
Urządzenie może być obsługiwane przez lekarza, pielęgniarkę, fizjoterapeutę lub dowolnie wyszkolony personel.
Przez okres 24 miesięcy nadzorujemy prawidłowe użytkowanie urządzenia z możliwością przedłużenia.
Poniżej efekty działania naszego urządzenia:
Zobacz VIDEO >>>
Nasza Plazma jest jedynym na rynku urządzeniem w technologii Super Plazmy z wykorzystaniem elektrod zawierających zestaw najważniejszych pierwiastków, które podczas naświetlania przyspieszają znacznie proces leczenia.
Nasze urządzenie nie emituje promieniowania UVC - dlatego może być stosowana u dzieci.
1.Brak skutków ubocznych
2.Brak stosowania sterydów w trakcie leczenia
3.Bezpieczne dla dzieci
4.Natychmiastowe efekty w stanach zapalnych
5.Wzmocnienie układu odpornościowego
6.wiele innych …...
Światło wykorzystywane w Maszynie Plazmowej ma bardzo szerokie spektrum emisji tj. 285nm- 8000 nm. Synergicznie emituje trzy pasma światła (promieniowanie ultrafioletowe, promieniowanie widzialne oraz promieniowanie podczerwone) w jednym czasie co w połączeniu ze światłem plazmowym generowanym ze specjalnych elektrod węglowych daje wyjątkowe możliwości leczenia.
Lista schorzeń zalecana do naświetlań na które posiadamy procedury:
Chirurgia:
1.Odleżyny
2.Powikłania pooperacyjne
3.Trudno gojące się rany
4.Zakażenie rany
Choroby wewnętrzne:
1.Stopa cukrzycowa
Dermatologia:
1.Atopowe zapalenie skóry
2.Bielactwo nabyte
3.Łuszczyca
4.Łysienie plackowate
5.Poparzenia
6.Przebarwienia
7.Trądzik
Ortopedia:
1.Osteoporoza
2.Przepuklina dysku lędźwiowego
3.Przepuklina dysku szyjnego
4.RZS
5.Silne bóle krzyża
6.Skolioza
7.Zapalenie kości i stawów
8.Zapalenie kości i szpiku
9.Zapalenie okostnej barku
10.Złamania
11.Zwyrodnienia stawów
12.Zwyrodnienie stawu kolanowego
Otolaryngologia:
1.Ostre zapalenie zatok
2.Przewlekłe zapalenie gardła
3.Przewlekłe zapalenie ucha środkowego
Urologia:
1.Krwawienie z nerek
2.Niewydolność nerek
3.Ostre zapalenie pęcherza moczowego
Cena zakupu obejmuje:
1. Urządzenie wraz z dostawą pod wskazany adres lub odbiór w naszej placówce
2. Darmowe szkolenie oraz pełne wsparcie specjalistów
3. Elektrody w ilości 1000 sztuk (100 paczek x 10 sztuk) ok 10.000 naświetleń po 10 minut
4. Gwarancja 24 miesiące z możliwością przedłużenia
5. Dokumentacja techniczna
6. Procedury naświetlania dla danego rodzaju schorzenia
7. Monitoring prawidłowej pracy urządzenia
Zainteresowanych zakupem zapraszamy do kontaktu.
Tel. +48 887 979 330
Departament Obsługi Sprzedaży
Holding330
--------------------------------------------
Technologia
Generator Plazmowy:
Już 1898 r. powstał pierwszy Instytut Światłolecznictwa a jego założyciel
lekarz Nels R. Finser dostał w 1903 roku nagrodę Nobla za udowodnienie
leczniczego działania lampy plazmowej na toczeń gruźlicy i inne choroby skóry.
Generator Plazmowy Super Plasma - JCH33, jest nowoczesnym urządzeniem wykorzystującym tę metodę.
Generator Plazmowy emitując fale elektromagnetyczne o różnej częstotliwości w
jednym czasie powoduje produkcję witaminy D, serotoniny, odpowiada za regulację
zegara biologicznego, układ mikrobiotyczny, pobudza układ transportu powięzi,
pobudza wydzielanie naturalnych peptydów przeciwdrobnoustrojowych AMP.
Witamina D odgrywa istotną rolę w modulacji funkcji wrodzonego układu
odpornościowego i w odpowiedzi organizmu na drobnoustroje. Bierze ona aktywny
udział w produkcji naturalnych antybiotyków, zwanych też antydrobnoustrojowymi
(PAD) z wykorzystaniem receptorów szlaku Toll (TRL) obecnych na monocytach i
makrofagach. Do antybiotyków należą defensyny i katelicydyny. Antybiotyki naturalne
w swoim genomie posiadają sekwencję (VDRE) łączącą się z receptorem dla
witaminy D (VDR).
W piśmiennictwie publikowanych jest wiele prac, potwierdzających znaczenie
witaminy D w różnych schorzeniach układu oddechowego zarówno w rozwoju
choroby, jak i w leczeniu. Pierwszą jednostką chorobową badaną w tym kontekście
była gruźlica, obecnie wiadomo, że witamina D ma znaczenie w leczeniu również
innych infekcji układu oddechowego, zarówno bakteryjnych, jak i wirusowych.
Publikowane są również prace na temat udziału witaminy D w terapii astmy, POChP,
mukowiscydozy.
Oddziaływanie witaminy D na funkcję układu oddechowego sięga bardzo
daleko, do poziomu komórkowego i modyfikacji z wykorzystaniem receptora dla
witaminy D na poziomie genowym.
Pierwsze badania, jakie przeprowadzono w tej dziedzinie, dotyczyły wrodzonego
układu odpornościowego i prątków gruźlicy.
Wykorzystując model prątków gruźlicy udało się dokładnie prześledzić, w jaki sposób
witamina D reguluje reakcję organizmu na drobnoustrój. W chwili obecnej wiadomo,
że podobne reakcje dotyczyć mogą innych zakażeń bakteryjnych i wirusowych (1-4).
W odpowiedzi naszego organizmu na drobnoustroje włączone są tzw.
antybiotyki naturalne, inaczej antydrobnoustrojowe (PAD), do których produkcji
dochodzi z wykorzystaniem obecności na makrofagach i monocytach specjalnych
receptorów szlaku Toll (toll like receptors – TLR) oraz modulacji tych reakcji za
pomocą witaminy D.
ANTYBIOTYKI NATURALNE, ANTYDROBNOUSTROJOWE (PAD)
Defensyny i katelicydyny należą do tzw. antybiotyków antydrobnoustrojowych (PAD),
nazywanych także antybiotykami naturalnymi. Strukturalnie są to oligo i polipeptydy,
które zabijają drobnoustroje lub hamują ich wzrost. Działają bakteriobójczo na
bakterie Gram-ujemne i Gram-dodatnie, neutralizują toksyny, działają antywirusowo.
Działanie PAD polega m.in. na:
– działaniu chemotaktycznym na neutrofile, monocyty, kom. T,
– działaniu proangiogennym i naprawczym,
– indukcji cytokin w kk. nabłonkowych i monocytach,
– neutralizacji endotoksyn,
– degranulacji mastocytów i uwalnianiu histaminy,
– interakcji z komplementem,
– aktywacji komórek dendrytycznych,
– działaniu opsonizacyjnym,
– działaniu antagonistycznym na ACTH,
– zahamowaniu oksydazy neutrofili.
Generator Plazmowy emitując fale elektromagnetyczne o różnej częstotliwości w
jednym czasie powoduje produkcję oddziaływuje na układ kostny.
Układ endokrynny witaminy D odgrywa istotną rolę w regulacji homeostazy
wapniowej oraz w metabolizmie kostnym. W badaniach ostatnich dwóch dekad
udowodniono również rolę witaminy D w regulowaniu funkcji układu
immunologicznego. Niedobór tej witaminy jest związany z licznymi chorobami
nowotworowymi, autoimmunologicznymi i infekcyjnymi. Witamina D hamuje
wydzielanie parathormonu, odporność nabytą i proliferację komórek, a
jednocześnie promuje sekrecję insuliny, wrodzoną odporność oraz stymuluje
różnicowanie komórek. W pracy przedstawiono usystematyzowane wiadomości na
temat podstawowej roli witaminy D w modulowaniu różnych procesów
immunologicznych, takich jak: aktywacja i proliferacja limfocytów, różnicowanie
limfocytów Th, wytwarzanie swoistych przeciwciał oraz regulacja odpowiedzi
immunologicznej. Opisano również potencjał kliniczny metabolitów witaminy D w
modulowaniu antygenowoswoistej odpowiedzi immunologicznej oraz w profilaktyce i
leczeniu chorób zapalnych oraz zaburzeń układu immunologicznego wileu
Poniższe opracowanie ma na celu syntetyczną prezentację aktualnego stanu
wiedzy na temat mechanizmów działania witaminy D oraz wykazanie jej wpływu na
tkanki organizmu.
Zaburzenia depresyjne są najczęstszą przyczyną niepełnosprawności oraz wpływają
na ogólny stan zdrowia podobnie do innych schorzeń przewlekłych, a niekiedy nawet
bardziej niż one. Tradycyjne metody leczenia depresji z zastosowaniem farmakoterapii
lekami przeciwdepresyjnymi mają ograniczoną skuteczność . W powstawaniu zaburzeń
depresyjnych ma znaczenie wiele czynników i mechanizmów, a jak wskazują wyniki badań,
jednym z nich może być niedobór witaminy D3 . Receptory dla kalcytriolu (aktywnej formy
witaminy D3) stwierdza się niemal we wszystkich komórkach. Choć znaczenie tego związku
nie zostało do końca poznane, nie ulega wątpliwości, że pełni on funkcje regulacyjne w
wielu narządach i tkankach oraz jest niezbędny do prawidłowego funkcjonowania
gospodarki wapniowo-fosforanowej, gruczołów endokrynnych, układu odpornościowego
oraz nerwowego.
Aktywna forma witaminy D3, kalcitriol (1,25(OH)2), ma budowę steroidową wykazującą
działanie endokrynne, parakrynne oraz autokrynne. Udowodniono wpływ niedoboru
witaminy D3 na powstawanie różnych schorzeń, takich jak choroby autoimmunologiczne,
choroby sercowo-naczyniowe, infekcje, osteoporoza, otyłość, cukrzyca, niektóre nowotwory.
W ostatnich latach wykazano także związek pomiędzy zbyt niskim poziomem witaminy D3 a
chorobami neuropsychiatrycznymi, takimi jak stwardnienie rozsiane, choroba Alzheimera,
choroba Parkinsona, oraz między poziomem witaminy D3 a ogólnym osłabieniem w
zakresie funkcjonowania poznawczego.
Badania ostatniego dziesięciolecia wykazały udział witaminy D nie tylko w
procesach me- tabolicznych kości, ale również w procesach immunologicznych i
antykancerogennych. Powszechnie występujące niedobry tej witaminy wiążą się
z większymi konsekwencjami zdrowotnymi – m.in. ze zwiększoną
zachorowalnością i śmiertelnością z powodu chorób autoimmunologicznym i
nowotworowych. W związku z tym sugeruje się weryfikację zakresu wartości
referencyjnych witaminy D w surowicy krwi oraz modyfikację zaleceń dotyczących
jej suplementacji. Z kolei odkrycie receptora witaminy D (VDR) umożliwiło poznanie
jej wpływu na narządy poza kostne. Obecnie podkreśla się nowe właściwości
kalcytriolu ukazując jego działanie prewencyjne oraz możliwość zastosowania w
terapii wspomagającej wielu chorób.
Witamina D wpływa na wiele procesów fizjologicznych w organizmie człowieka,
stąd coraz częściej podkreśla się jej znaczenie w utrzymaniu stanu zdrowia. Jej
niedobory wiążą się ze zwiększoną zachorowalnością na choroby układu kostnego i
tkanek poza kostnych [34,36]. Niedostateczna synteza witaminy D w skórze oraz niska
podaż z dietą wiąże się z licznymi konsekwencjami zdrowotnymi m.in. z większym
ryzykiem kardiodiabetologicznym oraz wzrostem zachorowalności z powodu chorób
autoimmunologicznych i nowotworowych. Badania eksperymentalne,
epidemiologiczne i molekularne ostatniego dziesięciolecia podkreślają jej wpływ na
metabolizm tkanek i narządów poza kostnych [37,51]. Odkrycie receptorów VDR oraz
udowodnienie plejotropowego działania witaminy D otworzyło nowy rozdział w
medycynie. Zainteresowanie tym związkiem stało się podstawą do poszukiwania dotąd
nieznanych właściwości witaminy D – zwłaszcza jej udziału w procesach
autoimmunologicznych i nowotworowych [19,37,51,57,76]. Na uwagę zasługują przede
wszystkim rewolucyjne badania Stumpfa i współtwórców, którzy w 1979 r. wykazali
obecność receptorów VDR w tkankach i narządach niezwiązanych z gospodarką
wapniowo-fosforanową [69]. Wszystkie te przełomowe odkrycia ostatnich dziesięcioleci
pozwoliły na wykazanie nieznanych dotąd właściwości witaminy D i jej
pozagenomowego wpływu na tkanki poza kostne [16,17].
prekursory Witaminy d i jej przemiany metaboliczne w organizmie człowieka
Nazwa witamina D obejmuje grupę kilku związków, których wspólną cechą jest
cząsteczka zbudowana z czterech pierścieni (A, B, C, D) oraz łańcucha bocznego. Ze
względu na to, że charakteryzuje się ona otwartym pierścieniem B została włączona do
grupy związków sekoste- roidowych [2,6,37].
Prekursorami witaminy D są związki pochodzenia zwierzęcego - cholekalcyferol
(witamina D3) lub występujący w drożdżach i grzybach ergokalcyferol (witamina D2).
Substancje te różnią się budową łańcucha bocznego przy ugrupowaniu sterolowym.
Prowitamina D (7-dehydro- cholesterol) występuje w błonach komórkowych
keratynocytów (w warstwie podstawnej i kolczystej naskórka) oraz w fibroblastach skóry
właściwej [2]. Pod wpływem promieniowania słonecznego UVB lub naświetlania lampą
plazmową o długości fali 290-315 nm 7-dehydrocholesterol ulega w ciągu 30 minut
fotochemicznemu przekształceniu w skórze do cholekalcyferolu (kalciolu). Podczas tego
procesu dochodzi do zerwania podwójnego wiązania w pozycji węgla 9 i 10, otwarcia
pierścienia B oraz syntezy prowitaminy D, która szybko ulega izomeryzacji w
temperaturze skóry (25 °C) [2,6]. Prowitamina D występuje w błonach komórkowych
keratynocytów (w warstwie podstawnej i kolczystej naskórka) oraz w fibroblastach skóry
właściwej. Kalciol ma stabilną strukturę i jest uwalniany z błon do przestrzeni międzykomórkowej,
a następnie do krwi [12,37,58,80].
W kolejnych przemianach metabolicznych powstają związki biologicznie czynne.
Wytworzony w skórze cholekalcyferol ulega dwukrotnej hydroksylacji enzymatycznej.
Pierwsza zachodzi w wątrobie i prowadzi do powstania 25-hydroksy-cholekalcyferolu
[kalcydiolu, 25(OH)D3]. Proces ten jest katalizowany przez 25-hydroksylazę witaminy D
zależną od cyto- chromu P-450 (CYP27A1) [2,6,12]. Wprawdzie kalcydiol jest główną
postacią witaminy D w surowicy krwi, jednak jego aktywność biologiczna jest niewielka –
około 1,5-krotnie wyższa od cholekalcyferolu. Proces powstawania tego związku nie jest
ściśle kontrolowany, a tempo syntezy jest zależne od podaży przyjmowanej witaminy D z
dietą, lekami lub suplementami, dlatego uważany jest za marker pokrycia
zapotrzebowania na tę wita- minę. W badaniach na modelach zwierzęcych wykazano
wzrost stężenia 25(OH)D3 w surowicy podczas suplementacji dużymi dawkami witaminy
D, przy utrzymującym się na stałym poziomie stężeniu dihydroksy- metabolitu [40].
Kolejnym etapem przemian jest proces 1α-hydroksylacji pierścienia A kalcydiolu z
udziałem 1α-hydroksylazy (CYP27B1), który zachodzi w nerkach. Powstaje wówczas
drugi aktywny biologicznie związek – kalcytriol [1α,25 dihydroksycholekalcyferol,
1α,25(OH)2D3], nazywany również hormonem witaminowym [6,37]. Proces ten jest
regulowany przez stężenie samego metabolitu 1α,25(OH)2D3 oraz stężenie wapnia i
fosforanów w surowicy krwi z udziałem parathormonu (PTH). Aktywność kalcytriolu jest
1000-krotnie wyższa niż kalcydiolu, ale jego okres półtrwania jest krótszy i wynosi 4-6
godzin [16]. Badania ostatnich dziesięcioleci wykazały, że oprócz nerkowej 1α-
hydroksylacji proces ten zachodzi również w innych komórkach ludzkiego organizmu,
takich jak makrofagi, keratynocyty, łożysko, przytarczyce, mięśniówka gładka naczyń
oraz komórki nowotworowe. Dzięki temu miejscowo syntetyzowana witamina D, poprzez
regulację autoimpakrynną, wpływa na procesy fizjologiczne w miejscach jej syntezy [1,16,47].
W organizmie ludzkim zachodzi również 24-hydroksylacja prowadząca do
powstania 24,25-dihydroksy- cholekalcyferolu. Łańcuch boczny tego związku ulega
oksydatywnemu rozszczepieniu i powstaje kwas kalcytrionowy, który jest dobrze
rozpuszczalny w wodzie i łatwo usuwany z organizmu. Zainicjowane w ten sposób
procesy kataboliczne są zależne od stężenia kalcytriolu, który indukuje ekspresję 24-
hydroksylazy (CYP24A1), a synteza 1α,25(OH)2D3 jest regulowana na zasadzie
sprzężenia zwrotnego [10].
W przypadku niedoboru aktywnej postaci witaminy D, występuje oporność kości
na działanie parathormonu. Parathormon wpływa na regulację gospodarki wapniowofosforanowej
przez zwiększenie wchłaniania zwrotnego jonów wapnia w nerkach,
hamowanie zwrotnej resorpcji fosforanów, uwalnianie wapnia z kości oraz zwiększenie
syntezy kalcytriolu (przez aktywację 1-α-hydroksylazy). W przypadku niedoczynności
przytarczyc obserwuje się zmniejszoną syntezę PTH, a w konsekwencji hipokalcemię.
Natomiast w nadczynności przytarczyc dochodzi do zwiększonego uwalniania PTH, który
wpływa na wzrost stężenia wapnia w surowicy krwi. Hiperkalcemia może wywołać
powikłania mózgowe (wymioty), arytmię oraz osteoporozę [50,69].
budowa receptora Witaminy d (vdr)
Wpływ kalcytriolu i jego analogów na komórki docelowe odbywa się poprzez
receptor VDR (vitamin D receptor) [16,17,30,31,60]. Receptor ten występuje w
klasycznych komórkach docelowych, czyli nabłonku jelit, kanalikach nerkowych
oraz kościach [30]. VDR ma masę cząsteczkową około 55kDa i razem z
receptorami dla glikokortykosteroidów, steroidów płciowych, tyroksyny, retinoidów,
kwasów tłuszczowych i eikozanoidow należy do nadrodziny receptorów
hormonów steroidowych [31]. Jest on aktywatorem liganda w procesie regulacji
transkrypcji genów. Wysoce konserwatywna domena tego receptora zawiera tzw.
palce cynkowe i wiąże się z DNA. Charakterystyczna sekwencja w regionie
promotora genu docelowego VDRE (vitamin D-responsive element – VDRE) jest
rozpoznawana dzięki obecności trzech aminokwasów wchodzących w skład
jednego z palców cynkowych. Zmiany budowy domeny wiążącej się z ligandem
mogą się przyczyniać do braku lub słabej odpowiedzi na witaminę D [31,60]. W
pobliżu domeny wiążącej ligand występuje domena dimeryzacyjna, która wiąże
się z receptorem kwasu retynowego – RXR (retinoid x receptor) tworząc
heterodimer. Jest on aktywowany przez dołączenie 1α,25(OH)2D3, która działa
jak czyn- nik transkrypcyjny [30].
mechanizm działania 1α,25(oh)2d3
1. MECHANIZM GENOMOWY. Przyłączenie kalcytriolu do heterodimeru VDRRXR
zapoczątkowuje proces transkrypcji. Powstały kompleks łączy się z
promotorową sekwencją DNA i moduluje transkrypcję wielu genów (na którą
wpływają również kompleksy aktywujące receptorów steroidowych). Kalcytriol
kontroluje ekspresję ponad 200 genów, przy czym pełna odpowiedź na poziomie
genomu (genomic response – GR) jest obecna po kilku godzinach lub dniach
[31,60].Ligand aktywatora receptora NF-ĸB – RANKL (receptor activator of nuclear
factor kappa-B ligand) z udziałem kompleksu 1α,25(OH)2D3/VDR reguluje
osteoklastogenezę. Kompleks ten hamuje również ekspresję osteoprotegryny
(OPG) - glikoproteiny, która przez łączenie się z RANKL wpływa na różnicowanie i
aktywację osteoblastów. Większa aktywność RANKL nad OPG prowadzi do
dominacji procesów osteolitycznych i rozwoju osteopenii/osteoporozy. Duża
aktywność osteoprotegeryny stymuluje natomiast aktywność osteoblastów,
dominację procesów kościotworzenia i osteopetrozy (nadmiernego kostnienia)
[16,74].
2. MECHANIZM POZAGENOMOWY. Kalcytriol oprócz udowodnionego wpływu
na procesy transkrypcji genomowej wykazuje również działanie
pozagenomowe poprzez receptory błonowe [19,31,60]. Dzięki temu
dochodzi do aktywacji komórkowych proteaz i kinaz oraz wytwarzania
prostaglandyn, które są odpowiedzialne za niegenomowe właściwości witaminy
D. Odpowiedź niegenomowa jest szybka – trwa kilka sekund lub minut (rapid
response – RR). Wpływa ona na aktywację szlaków sygnałowych
charakterystycznych dla danej tkanki docelowej [52].
Odkrycie receptorów dla tego hormonu poza typowymi tkankami docelowymi
(wątrobą, nerkami i jelitami) w komórkach, takich jak makrofagi, keratynocyty, łożysko,
przytarczyce, mięśniówka gładka naczyń oraz komórkach nowotworowych
zapoczątkowało nową erę tej witaminy [16,46,57]. Jednoczasowe zidentyfikowanie
mitochondrialnej 1α-hydroksylazy w rożnych tkankach ludzkiego organizmu umożliwiło
potwierdzenie działania immunomodulacyjnego i antyproliferacyjnego kalcytriolu [16,46].
Wykazano wpływ tego związku na procesy apoptozy, proliferację i różnicowania się
komórek oraz wydzielanie insuliny.
Plejotropowe działanie Witaminy D
Badania Stumpfa otworzyły nowy rozdział w historii witaminy D i pozwoliły na odkrycie
nieznanego do tej pory działania pozakostnego w procesach autoimmunizacyjnych,
endokrynologicznych, kardioprotekcyjnych i przeciwnowotworowcych [69]. Odkrycie
receptora VDR w wielu komórkach i narządach organizmu umożliwiło poznanie
nowych mechanizmów działania tej witaminy oraz stworzyło podstawę do rozwoju
pierwszych prób farmakoterapii wielu chorób [16,17,30,31,60].
Działanie immunomodulujące Witaminy D
Witamina D jest regulatorem odpowiedzi immunologicznej, a jej receptory są
obecne w aktywowanych limfocytach T i B, neutrofilach, makrofagach i komórkach
dendrytycznych. Kalcytriol hamuje nadmierną ekspresję cytokin prozapalnych oraz
stymuluje obronę prze- ciwbakteryjną poprzez wpływ na neutrofile, monocyty oraz
komórki NK (natural killers). Jego synteza zachodzi z udziałem makrofagowej 1α-
hydroksylazy - enzymu, który sprzyja stymulacji komórek układu immunologicznego
do obrony przeciwbakteryjnej i aktywuje interferon gamma [17]. Dowodem są badania
nad gruźlicą, w których wykazano zwiększoną ekspresję genu witaminy D oraz genu
1α-hydroksylazy witaminy D w monocytach i makrofagach w przebiegu tej choroby.
Zwiększona ekspresja 1α-hydroksylazy podwyższa stężenia kalcytriolu, który indukuje
syntezę katelicydyny
– peptydu biorącego udział w degradacji MYCOBACTE- rium tuberculosis. W przypadku
niskich surowiczych stężeń 25-hydroksywitaminy D, nieprzekraczających 50 nmol/l (20
ng/ml), makrofagi i monocyty nie mają zdolności inicjowania wrodzonej odpowiedzi
immunologicznej. Występująca hipowitaminoza predysponuje do rozwoju gruźlicy i
wiąże się z bardziej agresywnym przebiegiem tej choroby. Konsekwencje niedoboru
witaminy D są większe w przypadku czarnoskórych Afroamerykanów, u których częściej
stwierdza się stany niedoboru, ponieważ melanina hamuje skórną syntezę 7-dehydrocholesterolu
[16,51]. działanie neuroprotekcyjne Witaminy D.
Receptory VDR występują również w centralnym i obwodowym układzie nerwowym.
W przypadku niewystarczającej syntezy witaminy D lub jej niskiej podaży z dietą częściej
obserwuje się zaburzenia kognitywne oraz rozwija się choroba Alzheimera [26]. Nawet
okresowe niedobory kalcytriolu mogą być związane ze zwiększoną zachorowalnością na
stwardnienie rozsiane, natomiast właściwa insolacja w dzieciństwie może zmniejszać
ryzyko tej choroby [5,20]. Dzięki działaniu neuroprotekcyjnemu witamina D działa
korzystnie w łagodnych zaburzeniach poznawczych stwierdzanych we wczesnym etapie
demencji starczej (MCI - mild cognitive impairment). Stwarza to nowe możliwości
leczenia wspomagającego (z udziałem suplementacji witaminą
D) wraz ze standardową farmakoterapią chorób neurodegeneracyjnych [5].
działanie kardioprotekcyjne Witaminy D.
Witamina D bierze również udział w etiopatogenezie wielu chorób sercowonaczyniowych.
Występuje zależność między małym stężeniem kalcytriolu w osoczu a
dużą aktywnością reninową osocza i wysokimi wartościami ciśnienia tętniczego.
Suplementacja 1α,25(OH)2D3hamuje syntezę reniny poprzez mechanizm receptorowy
(VDR), bez wpływu na stężenie wapnia w osoczu [49]. Ponadto 1,25-dihydroksywitamina
wpływa na kurczliwość mięśnia sercowego zmniejszając ryzyko sercowo-naczyniowe [79].
Jej właściwa podaż wiąże się ze zmniejszoną zachorowalnością na nadciśnienie tętnicze
oraz choroby serca u osób zamieszkujących tereny powyżej 35 stopnia szerokości
geograficznej [65,79] wpływ Witaminy d na gospodarkę węglowodanową
Ze względu na obecność 1α-hydroksylazy w komórkach trzustki przypuszcza się,
że kalcytriol może regulować również autokrynną sekrecję insuliny [61]. W przypadku
niewydolności nerek prowadzącej do obniżenia stężenia 1α,25(OH)2D3 dochodzi do
zaburzeń wydzielania insuliny, zmniejszenia wrażliwości komórek ß trzustki na
glikemię oraz insulinooporności tkanek obwodowych [11,19,59]. Obserwacje te
umożliwiły wysunięcie hipotezy, że kalcytriol zwiększa syntezę insuliny [11].
Udowodniono, że niedobory 1α,25(OH)2D3 współwystępują ze zwiększoną
zachorowalnością na cukrzycę typu 2, a prawidłowe stężenia w surowicy opóźniają
rozwój tej choroby u osób z upośledzoną tolerancją glukozy. W związku z tym w wielu
badaniach sugeruje się udział tej witaminy w rozwoju cukrzycy zarówno typu 1 jak i
typu 2 [19,59,61]. działanie antykancerogenne Witaminy D.
Ze względu na to, że 1α,25(OH)2D3 wpływa na ekspresję ponad 200 rożnych genów,
w tym genów biorących udział w proliferacji, różnicowaniu, apoptozie i angiogenezie
komórek, podkreśla się jej udział w procesach nowotworowych [52,57]. Co więcej, wśród
mieszkańców północnych rejonów kuli ziemskiej stwierdza się zwiększoną zachorowalność
i śmiertelność z powodu chłoniaków, nowotworów jelit, trzustki, gruczołu krokowego oraz
sutka w porównaniu do osób zamieszkujących niższe szerokości geograficzne [27,28,57].
Zarówno badania prospektywne, jak i epidemiologiczne wskazują, że stężenie 25-
hydroksywitaminy D poniżej 50 nmol/l (20 ng/ml) jest związane z 30-50% zwiększonym
ryzykiem zachorowania na nowotwory jelita grubego, prostaty i sutka oraz większą
śmiertelnością z powodu tych chorób [27,28]. Udowodniono, że kalcytriol zmniejsza
namnażanie się zarówno komórek prawidłowych, jak i nowotworowych oraz przyczynia
się do ich ostatecznego zróżnicowania [19,37,57]. Jego aktywność związana jest z
obecnością receptora VDR, który występuje m.in. w mózgu, gruczole krokowym, sutku i
komórkach jelita grubego [19,37]. W przypadku niskich stężeń witaminy D, zwłaszcza u
osób zamieszkujących strefę klimatyczną powyżej 35 stopnia szerokości geograficznej,
obserwuje się zwiększoną (nawet o 50%) zachorowalność na nowotwory jelita grubego,
trzustki, prostaty, piersi, jajnika i niektóre postacie białaczek [23]. Za antykancerogennym
wpływem witaminy D przemawia również ekspresja 1α-hydroksylazy w wielu tkankach poza
kostnych [19,37,57] oraz obniżona synteza tego enzymu w przypadku niektórych
nowotworów np. gruczołu krokowego [28]. Badania molekularne potwierdziły udział
kalcytriolu w regulacji cyklu komórkowego. Powstający kompleks 1α,25(OH)2D3/VDR
hamuje podziały komórki nowotworowej na granicy faz G1/G0. Zwiększona ekspresja VDR
wiąże się również z lepszym rokowaniem w przypadku choroby nowotworowej, co
wynika m.in. z możliwości zmniejszenia inwazyjności komórek oraz ryzyka przerzutów
nowotworowych [70]. Korzystny wpływ witaminy D udowodniono w przypadku hamowania
reakcji odrzucenia przeszczepu, silniejszy od naj- częściej stosowanej cyklosporyny
(badania na modelach zwierzęcych) z korzystnym zmniejszeniem podatności na
towarzyszące transplantacji infekcje grzybicze i wirusowe [78].
Wpływ Witaminy D na choroby skóry:
Do odkrycia działania przeciwzapalnego kalcytriolu oraz jego wpływu na stan skóry stały
się badania Morimoto, który wykazał ustąpienie zmian łuszczycowych po leczeniu
kalcytriolem u pacjenta z osteoporozą [56]. W badaniach klinicznych podkreśla się
korzystny wpływ witaminy D i jej aktywnych metabolitów w leczeniu łuszczycy [35].
Rola Witaminy D w chorobach reumatologicznych.
Niskie stężenia witaminy D wyraźnie korelują z nasileniem chorób o podłożu
autoimmunologicznym [16,19,60]. Hipowitaminoza wiąże się ze zwiększonym
ryzykiem rozwoju nie tylko cukrzycy typu 1, nowotworów, choroby Crohna,
stwardnienia rozsianego, schizofrenii i depresji, ale również ze zwiększoną
zachorowalnością na reumatoidalne zapalenie stawów, łuszczycę, fibromialgię oraz
zespół przewlekłego zmęczenia [1,37,38]. U podstawy wielu z tych chorób leży
zwiększona synteza IL1β oraz czynnika martwicy nowotworów TNF-α [71]. W odpowiedzi
na powstały stan zapalny witamina D i jej analogi modulują odpowiedź immunologiczną. W
przypadku RZS wpływa ona na zmniejszenie liczby limfocytów Th1 i Th17, zwiększenie
liczby komórek Th2 i Treg oraz ograniczenie wytwarzania cytokin prozapalnych przy
jednoczesnym nasileniu sekrecji cytokin przeciwzapalnych. Udowodniono, że kalcitriol
hamuje inwazję FLS w RZS, zmniejsza ekspresję MMP-1 indukowaną przez IL-1β [73],
wpływa na różnicowanie się limfocytów B [9] oraz komórek Th17, które pełnią istotną rolę
w rozwoju autoimmunizacji w przebiegu tej choroby [13]. W konsekwencji dochodzi do
zmniejszenia stanu zapalanego i ciężkości przebiegu RZS, a hamujący wpływ kalcytriolu
na ekspresję MMP-1 minimalizuje uszkodzenia tkanki chrzęstnej i kostnej [73].
W przebiegu RZS witamina D nie tylko działa protekcyjnie na komórki tkanki
chrzęstnej i kostnej [14,48,64], ale również modyfikuje funkcję synowiocytów podobnych
do fibroblastów (fibroblast-like synoviocyte, FLS). Są to komórki, które rozwinęły się
wskutek hiperplazji synowium, a syntetyzowane przez nie mediatory zapalenia oraz
proteazy biorą udział w destrukcji tkanki chrzęstnej i kostnej [48]. W FLS stwierdza się
zwiększoną ekspresję receptora VDR oraz genów Cyp27A1, Cyp2j3 i Cyp11A1 związanych z
hydroksylacją i syntezą metabolitów witaminy D [68]. Przypuszcza się, że nasilona
ekspresja genów docelowych może być związana (przynajmniej częściowo) z lokalną syntezą agonistów receptora VDR i
ich protekcyjnym wpływem na komórki docelowe [4].
Wyniki badań doświadczalnych stały się podstawą do wysunięcia hipotezy, że
niedobory witaminy D i jej metabolitów mogą zwiększać ryzyko FLS-indukowanych
zaburzeń chrząstki oraz mogą być związane z przyspieszoną utratą tkanki kostnej i
destrukcją stawów. Badania Rossini i współtwórców. oraz Craiga i współtwórców
potwierdziły wcześniejsze przypuszczenia wykazując dodatnią korelację między
niskimi stężeniami kalcytriolu a ciężkością RZS oraz ryzykiem rozwoju
niepełnosprawności [14,64]. Ponadto niedobór witaminy D zwiększa ryzyko rozwoju RZS
[48], a leczenie agonistami receptora VDR minimalizuje zaburzenia cytoszkieletu w
synowiocytach, zmniejsza ciężkość choroby oraz uszkodzenia stawowe [7]. W związku
z tym podaż witaminy D i jej analogów może stanowić potencjalne leczenie
wspomagające, które zapobiega i zmniejsza uszkodzenia stawowe.
W toczniu układowym występuje odwrotna zależność między stężeniem witaminy D a
aktywnością choroby mierzoną za pomocą skali SLEDAI (Systemic Lupus Ery- thematosus
Disease Activity Index) [66,67] lub SDI (Sys- temic Lupus International Collaborating Clinics
Damage Index) [77], aczkolwiek często zależność ta nie jest statystycznie istotna [66,67].
Obserwuje się również ujemną korelację między wysokimi wartościami przeciwciał antydsDNA
[3] i dodatnią korelację z niskimi stężeniami tych przeciwciał [72]. Niedoborom
witaminy D towarzyszy większa aktywność limfocytów B oraz interferonu α [62], większy
poziom zmęczenia oceniany za pomocą skali VAS [55,67], częściej obserwuje się
hipercholesterolemię, insulinooporność/cukrzycę i nadciśnienie tętnicze [55,77].
niedobory Witaminy D.
Niewystarczająca podaż witaminy D i jej niskie stężenie w surowicy krwi istotnie
zaburzają równowagę fizjologiczną organizmu i zwiększają ryzyko rozwoju wielu chorób
przewlekłych [1,34,36,80] (tabela 2). Wykazano, że niedobory tej witaminy występują u 1
miliarda ludzi na świecie – głównie u osób starszych zamieszkujących rejony
zurbanizowane Europy i Stanów Zjednoczonych [25,36]. Niskie stężenie kalcydiolu
nieprzekraczające 50 nmol/l (20 ng/ml) obserwuje się również u dzieci i osób młodych
(w niektórych regionach nawet u 50% młodzieży) [25].
zapotrzebowanie organizmu na Witaminę D.
Kalcydiol jest najlepszym wskaźnikiem stężenia witaminy D w organizmie [25,42,50],
ponieważ (w odróżnieniu od kalcytriolu) nie podlega mechanizmom regulującym [42].
Dotychczas uważano, że prawidłowe stężenie 25(OH)D3 powinno być wyższe niż 50
nmol/l (20 ng/ml) [50]. Obecnie za wartości prawidłowe przyjmuje się stężenie kalcydiolu
przekraczające przynajmniej 80 nmol/l (200 ng/ml) w surowicy [6,15], a za zakres
wartości rekomendowanych (adequacy) przyjmuje się prze- dział 70-100 nmol/l (30-40
ng/ml) [42]. Sugeruje się, by wartości te były nawet wyższe, aczkolwiek nie powinny
przekraczać najwyższego tolerowanego stężenia, czyli 250 nmol/l (100 ng/ml) (tolerable
uptake upper level) [29].
Źrodła Witaminy D:
Głównym źródłem witaminy D jest jej endogenna synteza w skórze dostarczająca
90% tej witaminy przez Generator Plazmowy (naświetlanie 10 minut raz na tydzień).
Powstaje ona podczas fotochemicznej konwersji 7-dehydrochole- sterolu pod wpływem
promieni ultrafioletowych UVB o długości fali 290-315 nm i natężeniu promieniowania
20 mJ/cm2 [54]. Udowodniono, że 15-minutowa insolacja prowadzi do syntezy takiej ilości
kalcydiolu we krwi, jaka byłaby osiągalna po spożyciu 10000-20000 IU cholekalcyferolu
(1,2) [40]. W przypadku długiej ekspozycji na słońce uruchamiają się procesy
degradacyjne i powstają nieaktywne związki, takie jak lumisterol i tachysterol [36], co
zapobiega toksycznemu nagromadzeniu się witaminy D w organizmie, a nadmiar
kalcydiolu jest odkładany w tkance tłuszczowej. W przypadku braku syntezy witaminy D
w miesiącach zimowych nadmiar ten jest uwalniany do krwiobiegu w ciągu kolejnych
dwóch miesięcy [18,21,36,45,63].
Egzogenne źródła witaminy D3 (tłuste ryby, tran, suszone grzyby) zawierają
stosunkowo mało cholekalcyferolu, a jedna porcja tych produktów dostarcza średnio 400-
500 IU witaminy D [21,22,36]. W jeszcze mniejszych ilościach występuje ergokalcyferol
(D2) obecny w niektórych roślinach i grzybach. Związek ten ma małą aktywność
biologiczną, działa znacznie krócej i ma odmienny profil toksykologiczny niż
cholekalcyferol [2,63]. Obecnie uważa się, że z dietą powinno się dostarczać średnio 25-
100 μg (1000 IU-4000 IU) witaminy D w ciągu doby. W świetle korzystnych doniesień
dotyczących cholekalcyferolu pojawia się konieczność ponownej analizy dziennego
zapotrzebowania dla poszczególnych grup ludności [42].
prawidłowa podaż Witaminy D.
Ze względu na powszechnie występujące niedobory - witamina D powinna być
uzupełniona za pomocą suplementacji farmakologicznej – zwłaszcza jeśli stężenie
kalcydiolu w surowicy jest poniżej 50 nmol/l (20 ng/ml) [15]. Nie ma jednak
jednoznacznych danych dotyczących dziennej zalecanej dawki niezbędnej do zachowania
optymalnego stężenia kalcydiolu we krwi. Wiadomo natomiast, że wzrost stężenia
kalcydiolu w surowicy z 50 do 80 nmol/l (20 do 32 ng/ml) poprawia aż o 45-65%
efektywność transportu wapnia w jelicie [32]. Badania prospektywne dotyczące oceny
suplementacji witaminą D w ilości 50 μg/d (począwszy od urodzenia) wykazują
zmniejszenie ryzyka rozwoju cukrzycy typu 1 o 80% [44].
Rekomendowane od 1989 r. dawki witaminy D wynoszące 200-600 IU/d wydają się
niewystarczające do pokrycia dziennego zapotrzebowania ze względu na powszechnie
występujące jej niedobory [6]. W związku z tym proponuje się weryfikację
dotychczasowych zaleceń sugerując zwiększenie podaży witaminy D dla zdrowych osób
dorosłych do przynajmniej 2000 IU/d [42], z możliwością zwiększenia jej dawki 2000-7000
IU/d w przypadku stwierdzonych niedoborów [6]. Obecnie są to tylko sugestie, natomiast
w 2010 r. Europejski Urząd ds. Bezpieczeństwa Żywności (EFSA) pozytywnie zaopiniował
dzienne zalecane spożycie witaminy D dla kobiet po 50 roku życia, na poziomie 20 μg/d
(800 IU) [21,22]. Jednak w przypadku małej insolacji, niewłaściwej suplementacji lub
zmniejszonej syntezy 7-dehydrocholesterolu w skórze występującej po 50 r.ż. zaleca się
prewencyjną dawkę witaminy D wynoszącą 800-1000 IU dziennie lub 50000 IU co 2-4
tygodnie oraz właściwe nasłonecznie [8,24,36,53]. Wykazano, że dawki osiągające nawet
do 10000 IU witaminy D są bezpieczne przez 5 miesięcy [75], a dawka podtrzymująca
powinna wynosić 50000 IU co 2-4 tygodnie [36,53]. Jeśli stwierdzono niedobór – wówczas
dawka witaminy D2 powinna wynosić 50000 IU co tydzień przez 8 tygodni. Gdyby po tym
czasie kontrolne stężenie 25-hydroksywitaminy D w surowicy nie osiągnęło wartości 75
nmol/l (30ng/ml) należy ponownie powtórzyć suplementację witaminy D w ilości 50000 IU
tygodniowo przez kolejne 8 tygodni [53].
W przypadku osób otyłych dawka prewencyjna wita- miny D powinna wynosić 1000-2000
IU dziennie lub 50000 IU co 1-2 tygodnie, a dawka podtrzymująca - 50000 IU witaminy D2
co 1, 2 lub 4 tygodnie (w zależności od stężenia kalcydiolu w surowicy). Dawkę 50000 IU
należy powtórzyć przez kolejne 2-3 miesiące, jeśli kontrolne stężenie 25-hydroksywitaminy
D w surowicy nie osiągnęło 75 nmol/l (30 ng/ml) [29,35,53].
Kobiety ciężarne i karmiące mają większe zapotrzebowanie na witaminę D ze względu na
przemiany związane ze wzrostem płodu, mogą bezpiecznie korzystać z Generatora
Plazmowego .
W związku z tym dobowa dawka witaminy D2 powinna wynosić 1000-2000 IU co 2
tygodnie, aż do 4000 IU/dzień. W badaniach klinicznych taka suplementacja okazała się
skuteczna i bezpieczna podczas stosowania przez 5 miesięcy [41,43]. Dawka
podtrzymująca powinna wynosić 50000 witaminy D2 co 2-4 tygodnie przez 2 miesiące
[33]. Powtarza się ją, jeśli stężenie 25-hydroksywitaminy D w surowicy jest poniżej 75
nmol/l (30 ng/ml) [29,35,53]. Należy jednak pamiętać, że w przypadku osób dorosłych
docelowe stężenie 2-hydroksywitaminy powinno mieścić się w przedziale 75-150 nmol/l,
co odpowiada 30-60 ng/ml [15,36,75]
------------------------------------------------
Piśmiennictwo
Alpert P.T., Shaikh U.: The effects of vitamin D deficiency and insufficiency on the endocrine and
paracrine systems. Biol. Res.
Nurs., 2007; 9: 117-129
[1]Armas L.A., Dowell S., Akhter M., Duthuluru S., Huerter C., Hollis B.W., Lund R., Heaney R.P.:
Ultraviolet-B radiation increases serum 25-hydroxyvitamin D levels: the effect of UVB dose and skin
color.
J. Am. Acad. Dermatol., 2007; 57: 588-593
[2]Bonakdar Z.S., Jahanshahifar L., Jahanshahifar F., Gholamreza- ei A.: Vitamin D deficiency and its
association with disease activi- ty in new cases of systemic lupus erythematosus. Lupus, 2011; 20:
1155-1160Brenner M., Linge C.P., Li W., Li W., Gulko P.S.: Increased synovial expression of nuclear
receptors correlates with arthritis protection: a possible novel genetically regulated homeostatic
mechanism. Ar- thritis Rheum., 2011; 63: 2918-2929
[3]Buell J.S., Dawson-Hughes B.: Vitamin D and neurocognitive dys- function: preventing “D”ecline?
Mol. Aspects Med., 2008; 29: 415-422
[4]Cannell J.J., Hollis B.W.: Use of vitamin D in clinical practice. Al- tern. Med. Rev., 2008; 13: 6-20
[5]Cantorna M.T., Hayes C.E., DeLuca H.F.: 1,25-Dihydroxychole- calciferol inhibits the progression
of arthritis in murine models of human arthritis. J. Nutr., 1998; 128: 68-72Chapuy M.C., Arlot M.E.,
Duboeuf F., Brun J., Crouzet B., Arnaud S., Delmas P.D., Meunier P.J.: Vitamin D3 and calcium to
prevent hip fractures in elderly women. N. Engl. J. Med., 1992; 327: 1637-1642
[6]Chen S., Sims G.P., Chen X.X., Gu Y.Y., Chen S., Lipsky P.E.: Modu- latory effects of 1,25-dihydroxyvitamin
D3 on human B cell differ- entiation. J. Immunol., 2007; 179: 1634-1647
[7] Cheng J.B., Levine M.A., Bell N.H., Mangelsdorf D.J., Russell D.W.: Genetic evidence that the human
CYP2R1 enzyme is a key vitamin D 25-hydroxylase. Proc. Natl. Acad. Sci. USA, 2004; 101: 7711-
7715
[8] Chiu K.C., Chu A., Go V.L. Saad M.F.: Hypovitaminosis D is as- sociated with insulin resistance
and β cell dysfunction. Am. J. Clin.
Nutr., 2004; 79: 820-825
[9] Chung M., Balk E.M., Brendel M., Ip S., Lau J., Lee J., Lichtenstein A., Patel K., Raman G.,
Tatsioni A., Terasawa T., Trikalinos T.A.: Vita- min D and calcium: a systematic review of health
outcomes. Evidence report/technology assessment 2009; 183: 1-420
[10]Colin E.M., Asmawidjaja P.S., van Hamburg J.P., Mus A.M., van Driel M., Hazes J.M., van Leeuwen
J.P., Lubberts E.: 1,25-dihydroxyvi- tamin D3 modulates Th17 polarization and interleukin-22
expression by memory T cells from patients with early rheumatoid arthritis.
Arthritis Rheum., 2010; 62: 132-142
[11] Craig S.M., Yu F., Curtis J.R., Alarcón G.S., Conn D.L., Jonas B., Callahan L.F., Smith E.A.,
Moreland L.W., Bridges S.L.Jr, Mikuls T.R.: Vitamin D status and its associations with disease activity
and se- verity in African Americans with recent-onset rheumatoid arthritis.
J. Rheumatol., 2010; 37: 275-281
[12]Dawson-Hughes B., Heaney R.P., Holick M.F., Lips P., Meunier P.J., Vieth R.: Estimates of
optimal vitamin D status. Osteoporos.
Int., 2005; 16: 713-716
[13]DeLuca H.F.: Overview of general physiologic features and func- tions of vitamin D. Am. J. Clin.
Nutr., 2004; 80: 1689S-1696S
[14]DeLuca H.F., Cantorna M.: Vitamin D: its role and uses in immu- nology. FASEB J., 2001; 15:
2579-2585
[15] Dietary Supplement Fact Sheet: Vitamin D Office of Dietary Supple- ments (ODS). National
Institutes of Health (NIH). Retrieved 2013-04-11
[16]Dusso A.S., Brown A.J., Slatopolsky E.: Vitamin D. Am. J. Physiol.
Renal. Physiol., 2005; 289: F8-F28
[17]Etgen T., Bickel H., Förstl H.: Metabolic and endocrine factors in mild cognitive impairment.
Ageing Res. Rev., 2010; 9: 280-288
[18]European Food Safety Authority (EFSA) Panel on Dietetic Pro- ducts, Nutrition and Allergies
(NDA). Scientific opinion on the sub- stantiation of health claims related to vitamin D and normal
func- tion of the immune system and inflammatory response (ID 154, 159), maintenance of normal
muscle function (ID 155) and maintenance of normal cardiovascular function (ID 159) pursuant to
Article 13(1) of Regulation (EC) No 1924/2006”. EFSA J., 2010; 8: 1468-1485
[19] European Food Safety Authority (EFSA) Panel on Dietetic Products, Nutrition and Allergies
(NDA). Scientific opinion on the substantiation of a health claim related to vitamin D and risk of falling
pursuant to Article 14 of Regulation (EC) No 1924/2006. EFSA J., 2011; 9: 2382-2400
[20]Giovannucci E.: Vitamin D status and cancer incidence and mor- tality. Adv. Exp. Med. Biol., 2008;
624: 31-42
[21]Glerup H., Mikkelsen K., Poulsen L., Hass E., Overbeck S., Thom- sen J., Charles P., Eriksen
E.F.: Commonly recommended daily intake of vitamin D is not sufficient if sunlight exposure is
limited. J. Intern.
Med., 2000; 247: 260-268
[22]Gordon C.M., DePeter K.C., Feldman H.A., Grace E., Emans S.J.: Prevalence of vitamin D
deficiency among healthy adolescents. Arch.
Pediatr. Adolesc. Med., 2004; 158: 531-537
Grant W.B.: Does vitamin D reduce the risk of dementia? J. Alimportance of blood 25-OH-D levels
and extra-renal 1α-hydroxylase
in the classical and nonclassical actions of 1α,25-dihydroxyvitamin D3. Semin. Dial., 2007; 20: 316-
324
[23]Juzeniene A., Moan J.: Beneficial effects of UV radiation other than via vitamin D production.
Dermatoendocrinol., 2012; 4: 109-117
[24]Kerr G.S., Sabahi I., Richards J.S., Caplan L., Cannon G.W., Re- imold A., Thiele G.M., Johnson
D., Mikuls T.R.: Prevalence of vitamin D insufficiency/deficiency in rheumatoid arthritis and
associations with disease severity and activity. J. Rheumatol., 2011; 38: 53-59
[25]Li Y.C.: Vitamin D regulation of the renin-angiotensin system.
J. Cell. Biochem., 2003; 88: 327-331
[26] Lips P.: Vitamin D deficiency and secondary hyperparathyro- idism in the elderly: consequences
for bone loss and fractures and therapeutic implications. Endocr. Rev., 2001; 22: 477-501
[27]Liu P.T., Stenger S., Li H., Wenzel L., Tan B.H., Krutzik S.R., Ochoa M.T., Schauber J., Wu K.,
Meinken C., Kamen D.L., Wagner M., Bals R., Steinmeyer A., Zügel U. i wsp.: Toll-like receptor
triggering of a vitamin D-mediated human antimicrobial response. Science, 2006; 311: 1770-1773
[28]Losel R.M., Falkenstein E., Feuring M., Schultz A., Tillmann H.C., Rossol-Haseroth K., Wehling
M.: Nongenomic steroid action: con- troversies,questions, and answers. Physiol. Rev., 2003; 83:
965-1016
[29]Malabanan A., Veronikis I.E., Holick M.F.: Redefining vitamin D insufficiency. Lancet, 1998; 351:
805-806
[30]Matsuoka L.Y., Wortsman J., Haddad J.G., Hollis B.W.: In vivo threshold for cutaneous synthesis
of vitamin D3. J. Lab. Clin. Med., 1989; 114: 301-305
[31]Mok C.C., Birmingham D.J., Leung H.W., Hebert L.A., Song H., Rovin B.H.: Vitamin D levels in
Chinese patients with systemic lupus erythematosus: relationship with disease activity, vascular risk
fac- tors and atherosclerosis. Rheumatology, 2012; 51: 644-652
[32]Morimoto S., Kumahara Y.: A patient with psoriasis cured by 1 alpha-hydroxyvitamin D3. Med. J.
Osaka Univ., 1985; 35: 51-54
[33]Nagpal S., Na S., Rathnachalam R.: Noncalcemic actions of vita- min D receptor ligands. Endocr.
Rev., 2005; 26: 662-687
[34]Nemere I., Yoshimoto Y., Norman A.W.: Calcium transport in per- fused duodena from normal
chicks: enhancement within fourteen minutes of exposure to 1,25-dihydroxyvitamin D3.
Endocrinology, 1984; 115: 1476-1483
[35]Norman A.W.: From vitamin D to hormone: fundamentals of the vitamin D endocrine system
essential for good health. Am. J. Clin.
Nutr., 2008; 88: 491S-499S
[36]Norman A.W.: Minireview: vitamin D receptor: new assignments for an already busy receptor.
Endocrinology, 2006; 147: 5542-5548
[37]Pittas A.G., Dawson-Hughes B.: Vitamin D and diabetes. J. Steroid Biochem. Mol. Biol., 2010;
121: 425-429
[38]Ritterhouse L.L., Crowe S.R., Niewold T.B., Kamen D.L., Macwana S.R., Roberts V.C., Dedeke A.B.,
Harley J.B., Scofield R.H., Guthridge J.M., James J.A.: Vitamin D deficiency is associated with an
increased autoimmune response in healthy individuals and in patients with systemic lupus
erythematosus. Ann. Rheum. Dis., 2011; 70: 1569-1574
[39]Ross A.C., Taylor C.L., Yaktine A.L., Del Valle H.B.: Dietary Refer- ence Intakes for Calcium and
Vitamin D. Washington DC: National Academies Press. 2011
nants and associations with disease activity and disability. Arthritis Res. Ther., 2010; 12: R216-R223
[65]Rostand S.G.: Ultraviolet light may contribute to geographic and racial blood pressure
differences. Hypertension, 1997; 30: 150-156
[66] Ruiz-Irastorza G., Egurbide M.V., Olivares N., Martinez-Berri- otxoa A., Aguirre C.: Vitamin D
deficiency in systemic lupus eryth- ematosus: prevalence, predictors and clinical consequences.
Rheu- matology, 2008; 47: 920-923
[67]Ruiz-Irastorza G., Gordo S., Olivares N., Egurbide M.V., Aguirre C.: Changes in vitamin D levels in
patients with systemic lupus erythe- matosus: Effects on fatigue, disease activity, and damage.
Arthritis Care Res., 2010; 62: 1160-1165
[68]Schuster I.: Cytochromes P450 are essential players in the vita- min D signaling system.
Biochim. Biophys. Acta, 2011; 1814: 186-199
[69] Stumpf W.E., Sar M., Reid F.A., Tanaka Y., DeLuca H.F.: Target cells for 1,25-dihydroxyvitamin
D3 in intestinal tract, stomach, kid- ney, skin, pituitary, and parathyroid. Science, 1979; 206: 1188-
1190
[70]Sung V., Feldman D.: 1,25-Dihydroxy-vitamin D3 decreases hu- man prostate cancer cell
adhesion and migration. Mol. Cell. Endo- crinol., 2000; 164: 133-143
[71] Szeto F.L., Sun J., Kong J., Duan Y., Liao A., Madara J.L., Li Y.C.: Involvement of the vitamin D
receptor in the regulation of NF-kap- paB activity in fibroblasts. J. Steroid Biochem. Mol. Biol., 2007;
103: 563-566
[72] Szodoray P., Tarr T., Bazso A., Poor G., Szegedi G., Kiss E.: The immunopathological role of
vitamin D in patients with SLE: data from a single centre registry in Hungary. Scand. J. Rheumatol.,
2011; 40: 122-126
[73]Tetlow L.C., Woolley D.E.: The effects of 1α,25-dihydroxyvitamin D3 on matrix metalloproteinase
and prostaglandin E2 production by cells of the rheumatoid lesion. Arthritis Res., 1999; 1: 63-70
[74] Trouvin A.P., Goëb V.: Receptor activator of nuclear factor-κB ligand and osteoprotegerin:
maintaining the balance to prevent bone loss. Clin. Interv. Aging, 2010; 5: 345-354
[75]Vieth R.: Why the optimal requirement for vitamin D3 is prob- ably much higher than what is
officially recommended for adults.
J. Steroid Biochem. Mol. Biol., 2004; 89-90: 575-579
[76]Wolf G.: The discovery of vitamin D: the contribution of Adolf Windaus. J. Nutr., 2004; 134:
1299-1302
[77]Wu P.W., Rhew E.Y., Dyer A.R., Dunlop D.D., Langman C.B., Price H., Sutton-Tyrrell K., McPherson
D.D., Edmundowicz D., Kondos G.T., Ramsey-Goldman R.: 25-hydroxyvitamin D and
cardiovascular risk factors in women with systemic lupus erythematosus. Arthritis Rheum., Arthritis
Care Res., 2009; 61: 1387-1395
[78] Zhang A.B., Zheng S.S.: Strong additive effect of calcitriol and cyclosporine A on lymphocyte
proliferation in vitro and rat liver allotransplantations in vivo. Chin. Med. J., 2006; 119; 2090-2095
[79] Zittermann A.: Vitamin D and disease prevention with special reference to cardiovascular
disease. Prog. Biophys. Mol. Biol., 2006; 92: 39-48
[80]Zittermann A., Gummert J.F., Börgermann J.: Vitamin D deficien- cy and mortality. Curr. Opin.
Clin. Nutr. Metab. Care, 2009; 12: 634-639
[81] [64] Rossini
M., Maddali Bongi S., La Montagna G., Minisola G., Malavolta
N., Bernini L., Cacace E., Sinigaglia L., Di Munno O., Adami
S.:
Vitamin D deficiency in rheumatoid arthritis: prevalence, determiAutorzy deklarują brak
potencjalnych konfliktów interesów.
Gwarancja
Sprzedający nie wprowadził informacji o gwarancji
Zwroty
Sprzedający nie wprowadził informacji o zwrotach




 (1)
(1)